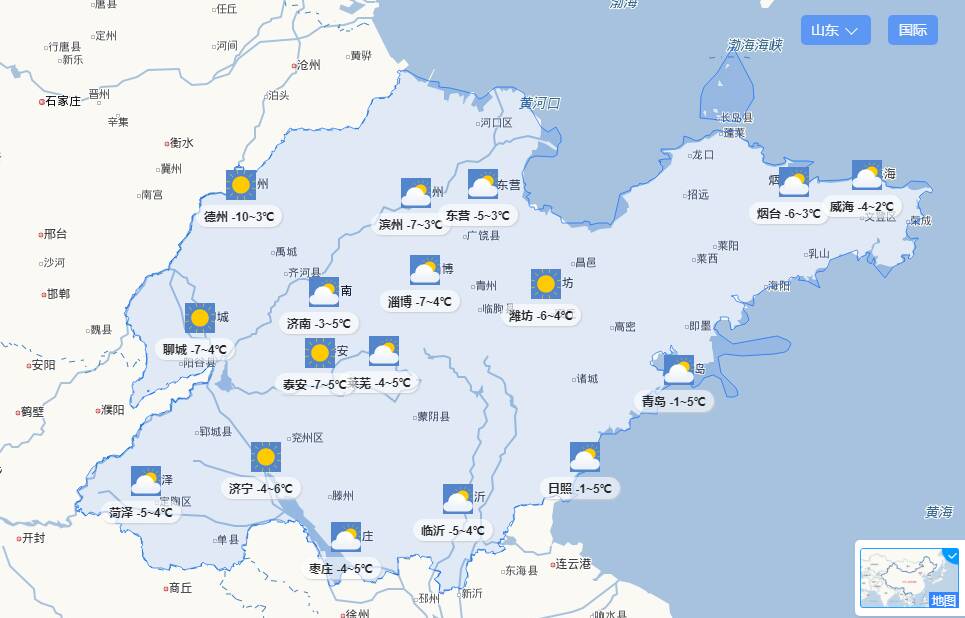
陆总医学研究院赵伟:干细胞治疗老年疾病的现状和展望
来源:医药卫生网
2018-09-04 11:07:09
神经干细胞(Neural Stem Cells, NSCs)是具有增殖、分化并能增殖自身的细胞。长期以来,人们一直认为成体脑内不存在NSCs,成年CNS的神经元是终末分化细胞,不可再生。1992年Reynolds和Weiss[1]首先自成年鼠纹状体中分离出NSCs,从而突破了成年组织不可再生的观点,为CNS功能的重建和再生带来希望。
1 NSCs的分布
干细胞(stem cells)是指有多种分化潜能和自我更新能力的细胞,如造血干细胞、胚胎干细胞、皮肤干细胞和消化干细胞等,成体脑组织中NSCs的存在是1992年Reynold等首先发现的。以后人们通过原始神经组织细胞表达的结构蛋白-Nestin(标志物),标志检测到NSCs在CNS分布广泛,如室管膜下区、海马齿状回颗粒细胞层下层、纹状体、隔、脊髓和大脑皮层等。Magavi等认为,室管膜睫状细胞可能是NSCs的来源。一般认为,成体脑中的NSCs主要分布于室下区和海马两个特定区域,但也有人认为NSCs普遍存在于脑组织中,而不是几个散在的区域。
2 NSCs的生物学特性
NSCs具有两个显著的生物特性:一是具有高度的自我更新能力,能够重复进行有丝分裂,产生大量子代细胞;二是在一定条件下可以分化成神经细胞和神经胶质细胞(包括星形胶质细胞和少质胶质细胞)。有人认为
其增殖方式有两种:A. 对称分裂(symmitic cell division),形成两个相同的子干细胞;B. 非对称分裂(asymmetic cell division),即干细胞分裂后的两个子细胞一个为干细胞,而另一个为祖细胞,祖细胞在外界刺激因子的作用下可以向多个细胞系的终末期分化。
3 NSCs的增殖、分化和迁移
NSCs的增殖、分化受体内、外环境中多种复杂因子的调控和影响。Meltzor和Svendsen等认为,NSCs和神经祖细胞的发育过程中,外源信号(尤其是所接触部位的外源信号)的影响,导致NSCs和祖细胞分化为所移植区域相似的细胞。外源信号的作用分两种:一是选择性控制,即信号只能调节干细胞的存活和增殖,而不影响其它细胞的分化方向;二是指导作用,特异性指导干细胞、祖细胞向特定谱系分化。
实验研究证明,NSCs的增殖、分化和迁移与细胞外基质有非常密切的关系,这些基质包括:各种胶原、可溶性细胞因子、化学介质、蛋白多糖、糖蛋白、肽类、脂肪酸和各种小分子物质等。如有的学者应用胎儿来源的神经细胞进行培养,细胞在碱性成纤维细胞生长因子(bFGF)的刺激下可分裂和增殖,对单个细胞进行克隆实验,获得了一个克隆细胞系;这个细胞系可以在培养的条件下扩谱,通过免疫化学研究证明此细胞有多种方向的分化潜能。
4 NSCs治疗CNS疾病的研究现状及前景
4.1 NSCs治疗帕金森病的研究
目前,NSCs治疗帕金森氏病(PD)的方案有二:一是细胞移植或细胞替代;二是NSCs作为基因治疗的载体。
Bjorklund等从人胚胎的腹侧中脑内分离出黑质细胞并植入PD患者脑中,结果发现有一半以上的患者症状明显改善,而且效果持续存在。Thor Ostenfeld等发现,移植术后10天,PD患者被移植的神经元仍然存活着,并且持续产生多巴胺。最近有人设想通过诱导PD病变本身的NSCs进行增殖分化,如此实验获得成功,那么PD的治疗将不再是医学难题。然而,诱导NSCs向多巴胺能神经元分化的条件十分复杂,目前尚处于探索阶段。相信人们终将诱导出与内源性DA神经元理化性质完全性同的细胞。
传统的载体细胞分为三大类:即细胞系、元代神经元和原代非神经元。它们作为载体均有自身的缺点,如免疫排斥反应和成瘤的危险性等。NSCs是最理想的载体细胞,较易用经典的途径转入目的基因,植入体内后根据所处的环境分化成相应的细胞,并与宿主形成突触联系。目前,NSCs用于体外传导神经递质合成酶酪氨酸羟化酶的基因用于治疗PD已有报道。另外,已经发现多种神经营养因子对DA能神经元有明显的保护作用,其中EGF(表皮生长因子)和bFGF(碱性成纤维生长因子)对DA能神经元的保护作用相对特异并且显著。如将这些神经营养因子导入NSCs,DA能神经元的状态将改善,DA能神经元病变的发展和衰亡将被阻止,甚至可促使病变DA能神经元的结构和功能恢复。
4.2 NSCs与缺血性脑损伤
无论发育期还是成年CNS都存在NSCs,成年CNS中一定数量的NSCs以休眠、不增殖状态存活于脑内并受CNS调控。当CNS受损或变性时,细胞内环境发生改变,NSCs被激活,从而进行自我修复,但其修复作用是有限的。如何通过人工干预,发挥内源性NSCs的修复作用,一直是人们研究的主题。
Takagi等研究发现,小鼠短暂性脑缺血15分钟后,NSCs增殖即加速,7天时NSCs的数量最多。有学者认为,轻度缺血可促进NSCs增殖,而重度缺血则有可能是NSCs减少。研究表明,成年哺乳动物大脑中NSCs分布广泛。临床上发现脑缺血患者在2个月内已有部分神经功能恢复,这可能是缺血灶周围细胞功能的代偿,也可能是缺血诱发局部NSCs增殖和分化。是什么因素诱发了NSCs增殖和分化呢?目前已知BDNF、EGF、bFGF、NTFs、PTEN、reelin、shh、BMP、促红素、TGF-a、noggin、PDGF-AA和PDGF-BB等均对NSCs有影响。Martens通过微型渗透真空泵向小鼠第四脑室单独或联合注入EGF、FGFz,分别加入或不加入肝素,持续6天时间,在第4、5、6天注入EGF、FGFz、肝素组产生了最大的增殖效应,促进了第四脑室及脊髓中央管周围的BrdU(+)、nestin(+)细胞的增生。有人[14]发现,PTEN可以调控室管膜下区NSCs的功能,特别对缺氧引起的细胞迁移和凋亡作用显著。目前,国内外临床上普遍使用的多肽类药物,如脑多肽、脑活素、神经生长因子、脑蛋白水解物等是否可通过血脑屏障,对NSCs的增殖和迁移有无影响,如何影响NSCs的迁移和增殖,尚不清楚。
4.3 NSCs与脑外伤
急性脑损伤的皮层中,许多造成继发性脑损伤的细胞因子或分子物质有高表达。这些表达有其破坏性,使神经细胞损伤加重,如兴奋性氨基酸、钙离子超载、氧自由基等,但也可能存在有利于NSCs增殖和修复的益处。有人认为,脑损伤可造成中间丝状蛋白nestin和细胞修复蛋白cyclinD1的表达,故受损的神经组织可提供一个类似于胚胎的微环境,适合于NSCs生存。有学者发现人类NSCs在急性脑损伤大鼠的顶叶皮层中可以生存,而且具有分化成神经元和胶质细胞的多型分化潜能。有资料显示,将NSCs移植到受损的脑组织后,可以良好生长、分化并嵌合于宿主的脑组织中,与其他神经元建立通路,从而使受损脑组织达到解剖和功能上的修复。说明NSCs移植对颅脑损伤有一定的治疗作用。
4.4 自体外周血NSCs移植治疗多发性硬化
多发性硬化(MS)是以CNS白质脱髓鞘病变为特点的自身免疫性疾病。由于脱髓鞘病变的部位和程度不同,而出现肢体瘫痪、共济失调、视力障碍、眼球震颤和感觉障碍等症状和体征,病情容易反复发作,进展较快,常导致病人死亡。NSCs的研究为MS的治疗带来了希望。
自体外周血干细胞移植是近年来发展较快的一项治疗技术,实验证明自体外周血干细胞移植是治疗MS的一种有效并且前景广阔的方法。此技术首先是用细胞刺激因子(G-CSF)动员骨髓内干细胞向外周血中迁移,然后抽取静脉血采集,净化(用免疫磁珠法等选择CD34+标志物标志的造血干细胞),给患者化疗药物或进行放射,此步骤叫预处理,预处理后的患者接近“免疫缺失”状态,最后将外周血干细胞颈静脉输给MS患者体内。Karussis等用环磷酰胺(CY)和放照的方法对MS动物模型小鼠进行免疫抑制,然后分别进行不同时期的同基因的骨髓移植;结果发现,对于尚未出现症状的MS小鼠,移植后不出现任何症状,已经出现症状的MS小鼠,移植后症状明显减轻并且不再发展。
由于外周血造血干细胞移植需要通过放射或化疗将病人首先处于“免疫缺失”状态,故有一定的危险性,所以此方法仅适用于难以控制病情进展的或反复发作的MS病人。截至2001年欧洲骨髓移植协会收录的85例MS患者,用G-CSF(集落细胞刺激因子)或G-SCF联合CY(环磷酰胺)进行动员,用BEAM方案(卡氮芥、鬼臼乙叉甙、阿糖胞苷、左旋苯丙氨酸氮芥联合化疗方案)进行预处理,然后进行外周血造血干细胞移植,结果78例耐受移植,7例发生相关因素死亡,死亡原因主要是感染并发症;移植后20例无效,20例病情稳定下来,39例病情明显好转;72%的患者存活时间在3年以上,并且病情也稳定,优于传统B-干扰素疗法(3年生存率60%)。
4.5 NSCs与脑肿瘤基因治疗
脑肿瘤的基因治疗效果取决于目的基因和载体系统。人们发现,NSCs具有分化潜能、迁移能力强和免疫原性地下等优点,是一种应用前景广阔的基因载体。
其过程大致为:首先培养出足够量的NSCs,然后对NSCs进行基因修饰,是用传染性较高的病毒载体将目的基因(如胞嘧啶脱氨酶基因)导入NSCs,最后颈携带目的基因的NSCs载体注入肿瘤体内。目的基因稳定表达,携带目的基因的NSCs“包围”和“追踪”肿瘤组织和细胞,投入与目的基因有关的药物后,药物和目的基因特异性结合,肿瘤细胞被杀死。已经发现能和载体结合的目的基因很多,如肿瘤信号传导因子、促凋亡基因、细胞周期调节因子、免疫增强剂、血管生成抑制因子和肿瘤坏死因子等。
Aboody等应用NSCs作为载体进行脑胶质瘤的基因治疗,他们将胞嘧啶脱氨酶(cytosine deaminase, CD)基因导入NSCs,再将携带CD基因的NSCs注入胶质瘤动物模型的瘤体内,结果发现NSCs迅速扩散到整个瘤床,部分NSCs“包围”肿瘤组织,并能够“追踪”向正常组织侵润的肿瘤细胞。
人们发现,NSCs载体的定向和远距离迁移的能力是其他载体无法比拟的。当NSCs从远离肿瘤部位注入时,它可以穿过正常的脑组织(包括血脑屏障),直接向肿瘤组织迁移。Chen等在脑缺血-再灌注损伤后的Wistar大鼠尾静脉注射骨髓基质细胞,证明了移植细胞透过血脑屏障后主要分布于缺血损伤区,明显减轻了神经功能的缺陷。Lu等经颈内动脉注射骨髓间充质干细胞,发现骨髓间充质干细胞不仅通过血脑屏障分布于脑损伤区、胼胝体、大脑皮质等部位,而且培养骨髓间充质干细胞时加入神经生长因子(NGF)和脑源性神经营养因子(BDNF)可促进骨髓间充质干细胞定向迁移进入大脑。
5 NSCs治疗CNS疾病的展望
NSCs存在于CNS已经得到证实。当CNS发生病变时,在机体自动调控下,内源性NSCs可能参与病变组织的修复。外源性NSCs是否自动迁移到病变组织参与修复,目前尚不能肯定。在无人为干预的情况下,无论是内源性或者外源性NSCs参与的修复作用都是微弱的。如何最大限度地发挥NSCs在CNS疾病中的治疗作用,是人们研究的重要课题。相信,通过人们的不懈努力,一定能在不久的将来NSCs治疗老年人CNS疾病方面的有所突破。但也应该看到,NSCs的研究刚刚起步,人们对它的认识还很少,问题和难点很多,工作任重而道远。
(来源:医药卫生网)
想爆料?请登录《阳光连线》( http://minsheng.iqilu.com/)、拨打新闻热线0531-66661234或96678,或登录齐鲁网官方微博(@齐鲁网)提供新闻线索。齐鲁网广告热线0531-81695052,诚邀合作伙伴。
廖勇医生:冬季敏感性肌肤如何自救,大咖为你支招!
- [详细]
- 医药卫生网 2021-01-06
“买4个疗程保终身”,医保之外,慈善赠药惠及更多肿瘤患者
- [详细]
- 医药卫生网 2021-01-06
彭城自古多豪杰,访徐州市贾汪区瑞金医院创建人郭芳女士
- [详细]
- 医药卫生网 2021-01-06
石家庄治男科哪家医院比较专业 推荐石家庄蓝天中医院
- [详细]
- 医药卫生网 2021-01-06
年度爆款:主打“航空科技”的雷霆暴风A380三代
- [详细]
- 医药卫生网 2021-01-06
【案例科普】双相情感障碍
- [详细]
- 齐鲁网 2021-01-06
赌为什么戒不掉?下面这些话一定对你有用!
- [详细]
- 齐鲁网 2021-01-06
每天喝酒,持续35年,成了酒精依赖症怎么治疗?
- [详细]
- 齐鲁网 2021-01-06
“青春痘”不用治,人长大就好了?中到重度的痤疮须到皮肤科治疗
- 15岁的刘同学,这两年脸上长满小丘疹、脓疱。家长认为这是“青春痘”不用管,人长大就好了。最近小刘的“青春痘”越来越严重,父母带他到湖...[详细]
- 长沙晚报 2021-01-06
植发机构调整业务范围,进一步关注毛发健康需求
- [详细]
- 医药卫生网 2021-01-06
红枣补血不如猪肝 贫血者还需要补气
- 生活中有不少女性看起来面色苍白、唇甲色淡,容易头晕、眼花、乏力,或者体检时发现血红蛋白含量低于正常值,这都是重要的贫血信号。出现贫...[详细]
- 中国妇女报 2021-01-06
注射用重组人凝血因子VIII诺易®获批,为血友病患者带来新治疗选择!
- [详细]
- 医药卫生网 2021-01-05